



近日,中南大学湘雅三医院放射科容鹏飞教授团队在国际权威期刊《Chemical Engineering Journal》(化学工程杂志,中科院1区TOP期刊,IF = 13.4)以Research Article形式发表题为“Epigenetic nanoplatform for synergistic immune activation and immunogenicity restoration enhancing cancer radio-immunotherapy”(表观遗传学纳米平台协同免疫激活和免疫原性恢复增强癌症放射免疫治疗)的原创研究论文。容鹏飞教授为独立通讯作者,何真虎博士为独立第一作者,中南大学湘雅三医院放射科为论文第一及通讯作者单位。

肝细胞癌(HCC)具有恶性程度高、进展快的特点,约70%患者确诊时已失去手术机会,需依赖放疗等综合治疗。放疗通过诱导肿瘤细胞DNA损伤直接杀伤肿瘤,同时激活cGAS-STING通路和免疫原性细胞死亡,引发抗肿瘤免疫应答。然而,放疗后肿瘤微环境(TME)的动态演变导致多重屏障:乏氧加剧促使免疫抑制细胞浸润、肿瘤细胞通过表观遗传沉默下调STING信号及抗原呈递分子MHC-I以及逃避免疫识别。上述机制导致放疗后免疫应答短暂,成为HCC治疗失败的重要原因。
针对这一难题,容鹏飞教授团队构建了pH响应型表观遗传探针HM-PEG/D,通过三重协同机制突破肿瘤微环境屏障:1. 酸性微环境触发地西他滨释放,逆转cGAS/GSDME基因甲基化并上调MHC I,激活CD8⁺ T细胞靶向攻击;2. MnO₂催化分解H₂O₂产氧增效放疗,激活cGAS-STING通路并引发caspase-3介导的肿瘤细胞焦亡;3. 细胞焦亡与STING通路协同形成免疫级联效应,驱动DC-CD8⁺ T细胞轴心活化,构建多层次抗肿瘤免疫网络,显著提升放疗后免疫应答强度与广度。动物实验表明,该策略显著抑制HCC生长并延长生存期。同时,通过磁共振成像可实时监测肿瘤,指导精准治疗。机制上,HM-PEG/D实现了放疗增效、免疫识别恢复、TME重塑的协同闭环,为攻克肝癌放射抵抗和免疫逃逸提供了新思路。
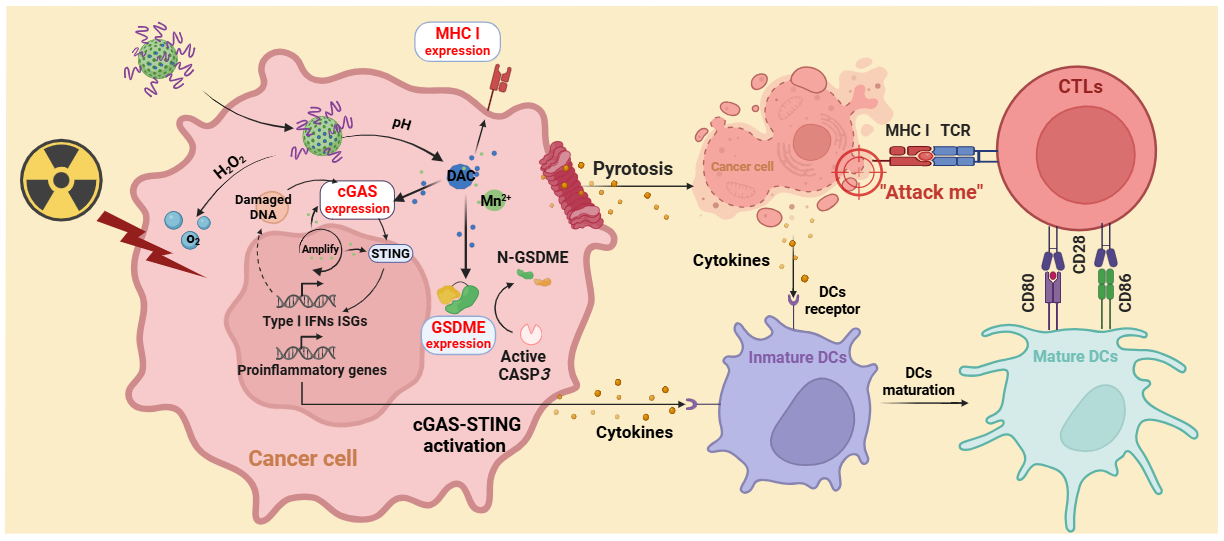
该研究首创了表观遗传-催化-免疫调控多功能磁共振分子探针,同步破解TME乏氧、免疫抑制及抗原呈递缺陷三大瓶颈。通过焦亡-STING-MHC I级联反应,将放疗“冷肿瘤”转化为免疫“热肿瘤”。同时,该分子探针兼具诊疗一体化功能,为肝癌个体化放射免疫联合治疗奠定基础。以上成果在国家自然科学基金、湖南省重点研发计划项目基金及湘雅三医院汇智育才项目基金的资助下,由课题组成员独立完成。
[上一篇] 中南大学湘雅三医院召开第六届二次教职工、...
[下一篇] 携手十二载,帮扶结硕果——湘雅三医院对口...
人民网 | 新华网 | 中华人民共和国国家卫生健康委员会 | 中华人民共和国教育部 | 湖南省政府 | 红网 | 湖南省卫生健康委员会 | 湖南省教育厅 | 中南大学 | 湘雅医学院 | 湘雅医院 | 湘雅二医院 | 协和医院 | 华西医院 | 西京医院 | 瑞金医院 | 复旦中山医院 | 武汉同济医院 | 中山医院
医院地址:湖南省长沙市河西岳麓区桐梓坡路138号 中南大学湘雅三医院 版权所有
湘教QS3-200505-000574 备案序号:湘ICP备05001139号 今日访问人数:23704 总访问人数:440586442